



《高中化学《第四章 溶液化学与离子平衡》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为3.8 MB,总共有90页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 90页
- 3.8 MB
- VIP模板
- ppt
- 数字产品不支持退货
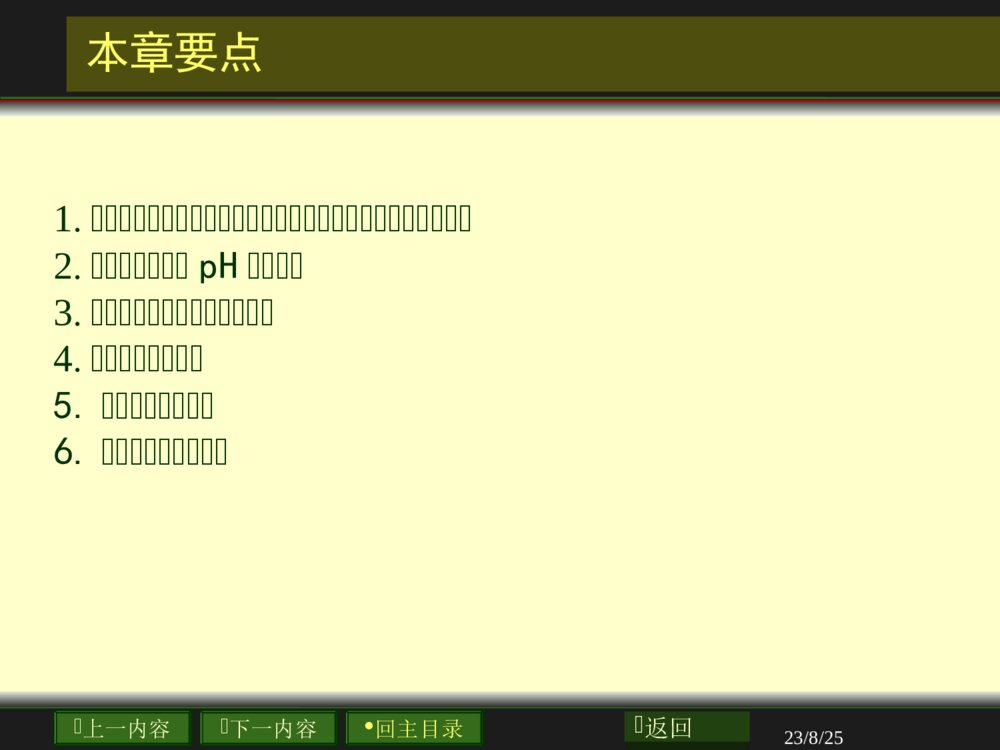
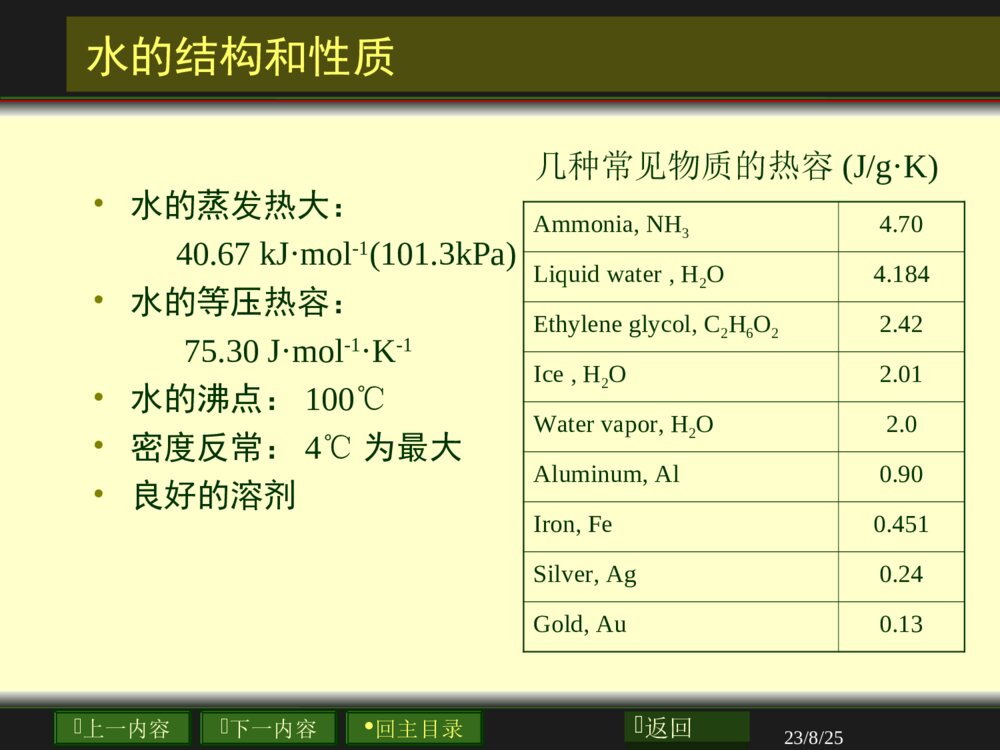
上一内容下一内容回主目录返回第四章溶液化学与离子平衡上一内容下一内容回主目录返回23/8/25本章要点1.2.pH3.4.5.6.上一内容下一内容回主目录返回23/8/25水的结构和性质4.1.1上一内容下一内容回主目录返回23/8/25水的结构和性质•水的蒸发热大:40.67kJ·mol-1(101.3kPa)•水的等压热容:75.30J·mol-1·K-1•水的沸点:100℃•密度反常:4℃为最大•良好的溶剂Ammonia,NH34.70Liquidwater,H2O4.184Ethyleneglycol,C2H6O22.42Ice,H2O2.01Watervapor,H2O2.0Aluminum,Al0.90Iron,Fe0.451Silver,Ag0.24Gold,Au0.13几种常见物质的热容(J/g·K)上一内容下一内容回主目录返回23/8/254.1溶液的通性-1solution上一内容下一内容回主目录返回23/8/254.1溶液的通性-2solventsolute上一内容下一内容回主目录返回23/8/254.1溶液的通性-3mixture上一内容下一内容回主目录返回23/8/254.2溶液组成的表示法B1.2.3.4.上一内容下一内容回主目录返回23/8/254.2溶液组成的表示法1.(molefraction)BxBBdef(nxn总)BB1★p108上一内容下一内容回主目录返回23/8/254.2溶液组成的表示法2.mBmolalityBBAdefnmmBAB-1kgmolp108上一内容下一内容回主目录返回23/8/254.2溶液组成的表示法3.cBmolarityBdefBncVBVBB3mmol3dmmol上一内容下一内容回主目录返回23/8/254.2溶液组成的表示法4.wBmassfraction)(BB总mmwBB1上一内容下一内容回主目录返回23/8/254.3溶液的蒸气压•如果把液体(如水)置于密闭的容器中,将发生蒸发与凝聚两个过程.•蒸发是吸热过程.是系统熵值增大的过程。•凝聚是放热过程,系统的熵值减小。上一内容下一内容回主目录返回23/8/25蒸气压的微观解释•由于液体在一定温度时的蒸发速率是恒定的,蒸发刚开始时,蒸气分子不多,凝聚的速率远小于蒸发的速率。随着蒸发的进行,蒸气浓度逐渐增大,凝聚的速率也就随之加大。当凝聚的速率和蒸气的速率达到相等时,液体和它的蒸气就处于平衡状态。此时.蒸气所具有的压力叫做该温度下液体的饱和蒸气压,或简称蒸气压。上一内容下一内容回主目录返回23/8/254.4稀溶液定律•溶液的通性:•1)蒸气压下降2)沸点上升•3)凝固点下降3)渗透压改变等•稀溶液定律:•难挥发的非电解质稀溶液的性质与一定量溶剂中所溶解溶质的物质的量成正比,又称为依数定律。以上性质又称为稀溶液的依数性。上一内容下一内容回主目录返回23/8/254.4稀溶液中的两个经验定律Raoult’sLaw1887RaoultAx*ApoAAAppxoAAB(1)ppxABoAoAppxp1BAxxABp108上一内容下一内容回主目录返回23/8/254.4稀溶液中的两个经验定律Henry’sLaw1803Henryxpxpkx/xxpkxkmBpkmBcckp上一内容下一内容回主目录返回23/8/254.4稀溶液中的两个经验定律(1)p(3)(2)HClH-ClHCl上一内容下一内容回主目录返回23/8/25BAooAAABppppx4.6蒸气压下降上一内容下一内容回主目录返回23/8/255-1100℃101.3kPa3.00g[CO(NH2)2]100g解:nurea=3.00/60.0=0.05molnwater=100.0/18.0=5.55molkPa904.03.10155.505.005.00pnnnpwaterureaureakPa4.100904.03.1010ppp4.6蒸气压下降性的例子上一内容下一内容回主目录返回23/8/25溶液蒸汽压下降的解释•溶液的蒸气压力比纯溶剂的要低,其原因可以理解如下:•由于溶剂溶解了难挥发的溶质,溶剂的一部分表面或多或少地被溶质的微粒所占据,从而使得单位时间内从溶液中蒸发出的溶剂分子数比原来从纯溶剂中蒸发出的分子数要少,也就是使得溶剂的蒸发速率变小。上一内容下一内容回主目录返回23/8/25物质的沸点和凝固点bp(boilPoint)()fp(freezingpoint)上一内容下一内容回主目录返回23/8/25freezingpointloweringcoefficientsfpk1Kmolkg。fpfpBTkm*fpfpfpTTTBm1molkg。fpkfpkfpT凝固点降低★p110上一内容下一内容回主目录返回23/8/25boilingpointelevationcoefficientsbpkkgmolK1bpTbpkbpkbpbpBTkm*bpbpbpTTT沸点升高p109上一内容下一内容回主目录返回上一内容下一内容回主目录返回23/8/25osmoticpressure溶液的渗透压(osmoticpressure)上一内容下一内容回主目录返回23/8/25渗透压:因溶液中的溶剂分子可以通过半透膜,而溶质分子不能透过半透膜而产生的压力,以符号Π表示。半透膜:只允许水分子自由通过而不允许溶质分子或离子通过的膜状物质如:细胞膜、肠衣、牛皮纸溶液的渗透压(osmoticpressure)上一内容下一内容回主目录返回23/8/25(范霍夫J.H.Vant.Hoff)方程:非电解质稀溶液渗透压的大小与溶液浓度的关系具有与理想气体状态方程式相同的形式。RTnVΠ:溶液的渗透压,kPaV:溶液的体积,dm-3n:溶质的物质的量,molc:溶液的浓度,mol·dm-3RTc或稀溶液渗透压p111上一内容下一内容回主目录返回23/8/25JacobusHenricusvan\'tHoffJacobusHenricusvan\'tHoff•(1852–1911)wasborninRotterdam,TheNetherlands,onAugust30,1852.•OfthenumerousdistinctionshehimselfmentionedtheawardofthefirstNobelPrizeinChemistry(1901)tohimastheculmination-pointofhiscareer.JacobusHenricusvan\'tHoffin1904上一内容下一内容回主目录返回23/8/25••20×105Pa7.7×105Pa“”“”0.9%5.0%溶液的渗透压产生的原因上一内容下一内容回主目录返回23/8/25溶液渗透压的应用上一内容下一内容回主目录返回23/8/25输液和渗透上一内容下一内容回主目录返回23/8/25例5-41dm-3溶液中含5.0g马的血红素,在298K时测得溶液的渗透压为1.80×102Pa,求马的血红素的摩尔质量。解:mVnRTRTM4135.08.3142986.910180101mRTMgmolV溶液渗透压的计算上一内容下一内容回主目录返回23/8/25反渗透技术•如果外加在溶液上的压力超过了渗透压,则反而会使溶液中的溶剂向纯溶剂方向流动,使纯溶剂的体积增加,这个过程叫做反渗透。•反渗透的原理广泛应用于海水淡化、工业废水或污水处理和溶液的浓缩等方面。上一内容下一内容回主目录返回23/8/25电解质溶液的通性上一内容下一内容回主目录返回23/8/25电解质溶液无依数性成立上一内容下一内容回主目录返回23/8/25G.N.Lewis4.10表观解离度与活度,B,BBxxaxi23100i值表示电解质溶液与同浓度的非电解质溶液的凝固点下降的比值。其中B为浓度,,B为活度系数,,B为活度。浓度越稀,离子活动的自由程度越大,活度系数越接近于1。上一内容下一内容回主目录返回23/8/25水的离解平衡和溶液的酸碱性•KwØ称为水的离子积(常数)。己精确测定过纯水中的H+浓度。在22℃时.纯水中含有c(H+)=1.00×10-7mol.L-1•因此,KwØ=[H+][OH-]=1.00×10-14•和其他弱电解质的离解有些不同,水离解时吸收的热量较多.故水的KwØ随温度的上升,有较大的增加。••+-2[H][OH]K=(2)[HO]+-w2K=K[HO][H][OH](3)•[H2O]H2O(l)H+OH-+★p121上一内容下一内容回主目录返回23/8/25水的离解平衡和溶液的酸碱性•值应不受H+和OH—离子浓度的影响。也就是说在水溶液中[H+]和[OH-]的乘积总是等于。因此,我们可以用H+浓度来表示水溶液的酸碱性。在18—25℃范围内:•纯水[H+]=[OH-]=10-7m01.L-1,pH=7•酸性溶液[H+]>[OH-]<10-7m01.L-1,pH<7•碱性溶液[H+]<[OH-]>10-7m01.L-1,pH>7•在工农业生产和科学实验中,常会用pH值表示水中H+离子浓度。wKwK上一内容下一内容回主目录返回pH7[H+]10-7pH7[H+]10-7pH7[H+]10-7141.0[]101.0H时一些物质的酸碱性上一内容下一内容回主目录返回23/8/25pH试纸pH计(酸度计)化学滴定pH值的测定上一内容下一内容回主目录返回23/8/25溴百里酚蓝酚酞甲基红酸碱指示剂及其在各种pH值下的颜色上一内容下一内容回主目录返回23/8/25水溶液中的单相离子平衡11)电离理论2)酸碱质子理论3)Lewis电子理论4)软硬酸碱理论上一内容下一内容回主目录返回23/8/25酸和碱的定义(电离理论)•根据电离理论,解离时所生成的正离子全部都是H+的化合物,叫做酸;所生成的负离子全部是OH-的化合物,则称做碱。•按照电离理论,NH3被认为是碱;Na2CO3被认为是盐。虽然两者的水溶液都呈碱性,而且Na2CO3俗称纯碱。上一内容下一内容回主目录返回23/8/25酸和碱的定义(质子理论)•酸碱质子理论又称为质子传递理论•该理论认为:凡能给出质子的物质(分子或离子)都是酸;凡能与质子结合的物质都是碱。•简单地说,酸是质子的给体,而碱是质子的受体。•酸碱质子理论对S酸碱的区分只以H+为判据,认为NH3和Na2CO3中的CO32-都是碱,两者水溶液pH值的计算均使用同一简单公式。上一内容下一内容回主目录返回23/8/251923年,Lewis提出:凡能接受电子对的物质称为路易斯酸凡能给出电子对的物质称为路易斯碱。GilbertNewtonLewisusingaslideruleathisdeskBABA::酸和碱的定义(路易斯酸理论)上一内容下一内容回主目录返回23/8/25酸和碱的共轭关系•根据质子理论,酸质子十碱•上面这种相互依存、相互转化的关系叫做酸碱的共轭关系。•酸失去质子后形成的碱叫做该酸的共轭碱,例如NH3是NH4+的共轭碱。•碱结合质子后形成的酸叫做该碱的共轭酸。•例如HCO3-是CO32-的共轭酸•★p122上一内容下一内容回主目录返回23/8/25酸和碱的共轭关系•酸与它的共轭碱(或碱与它的共轭酸)一起叫做共轭酸碱对。•任何共轭酸碱的解离常数之间都有同样的关系,即:•Ka、Kb互成反比•这体现了共轭酸碱之间的强度的关系,酸越强,其共轭碱越弱,强酸(如HCl、HNO3)的共轭碱(C1-、NO3-)碱性极弱.可认为是中性的。abwKKKp121上一内容下一内容回主目录返回23/8/25酸和碱在水溶液中的离子平衡及pH值计算•除少数强酸、强碱外,大多数酸和碱溶液中存在着解离平衡,即没有完全电离,其平衡常数又叫做解离常数,可分别用Ka和Kb表示,其值可用热力学数据求出,也可由实验测定。•一元酸、碱水溶液pH值的计算:•若以HA代表弱酸,可写成如下通式:•一元酸:•其解离常数为:-HA(aq)H(aq)+A(aq)+-[H][A]K(HA)=[HA]a上一内容下一内容回主目录返回23/8/25酸和碱在水溶液中的解离度•如上式所示:溶液的解离度a与其浓度c平方根成反比。即浓度越稀,解离度越大,这个关系式叫做稀释定律。-HA(aq)H(aq)+A(aq)22cK(HA)=cc(1-)K/aaaaaac上一内容下一内容回主目录返回23/8/25设[OH-]=x例计算0.10mol.l-1氨水溶液的[OH-]和pH值(Kb=1.79×10-5)。解:NH3H2ONH4++OH-平衡浓度(mol.L-1)0.10-xxx51.79100.10bxxKx/400bcKQ-531[]1.79100.101.3410xOHmollH14OH14(lg[OH])11.1pp酸或碱溶液的pH值计算上一内容下一内容回主目录返回23/8/25多元酸和碱在水溶液中的解离平衡•多元酸的解离是分级进行的、每一级都有一个解离常数,以H2S为例,其解离过程按以下两步进行。一级解离为:•H2S(aq)=H+(aq)十HS-(aq)(1)•HS-(aq)=H+(aq)十S2-(aq)(2)+2-2-[H][S]K=[HS]a+-12[H][HS]K=[HS]a上一内容下一内容回主目录返回23/8/25多元酸和碱在水溶液中的解离平衡一般情况下,二元酸的Ka2<



















